Establecimiento de la microbiota intestinal en lactantes alimentados con fórmulas con mezcla simbiótica adaptada a la edad de 6 HMOs, B. infantis y B. lactis : ensayo doble ciego aleatorizado
Objetivos:
Los oligosacáridos de la leche humana (HMO) impulsan en el intestino ek
desarrollo del microbioma en las primeras etapas de la vida a través de microbios capaces de metabolizar HMO específicos. B. infantis puede hacerlo y se reconoce cada vez más su contribución al desarrollo inmunológico postnatal temprano.
A nivel mundial se está observando una pérdida progresiva de bifidobacterias metabolizadoras de HMOs
En este ensayo se evaluaron los efectos moduladores del microbioma intestinal en lactantes alimentados con fórmulas suplementadas con 6 HMOs y dos probióticos desde el nacimiento hasta los 15 meses. En este artículo se presentan los resultados del análisis para todos los bebés hasta los 6 meses.
Métodos:
En un ensayo europeo multicéntrico los bebés alimentados con fórmula de ≤14 días fueron aleatorizados al control (n=117, parcialmente hidrolizado 100%
fórmula a base de suero) o fórmula de prueba (n=119, igual fórmula suplementada con 1,77 g/l de HMO [2’FL, DFL, 3-FL, LNT, 3’SL, 6’SL], B. lactis [CNCM I-3446; 1x10^6
UFC/g] y B. infantis [LMG11588; 5x10^5 UFC/g]).
Se inscribieron lactantes no aleatorizados (n=82) amamantados como referencia. Se permitió una dieta complementaria desde los 4 meses. Se recolectaron muestras fecales al inicio, a los 3 y 6 meses.
Se analizó la microbiota mediante metagenómica.
Los grupos fueron evaluados analizando la abundancia diferencial usando un modelo lineal mixto corregido con sesgo de composicionalidad para la edad inicial y el sitio de estudio, así como la prevalencia diferencial utilizando un modelo de regresión binomial lineal generalizado.
Resultados:
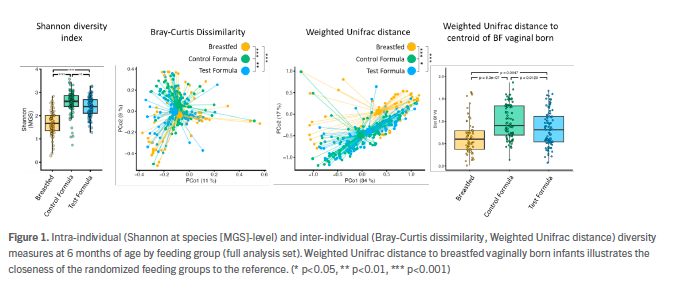
Al inicio, las medidas de diversidad fueron similares entre losgrupos de prueba y control, mientras que a los 6 meses las medidas de diversidad tanto intra como interindividual mostraron diferencias significativas.
Las diferencias con los bebés alimentados con fórmula de prueba son más cercanas a
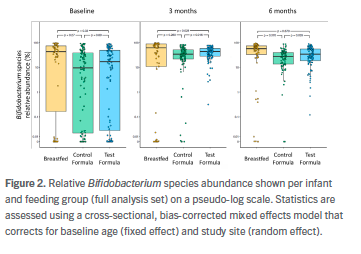
amamantar (Figura 1). A los 3 y 6 meses, con alimentación con fórmula los bebés tenían una abundancia significativamente mayor de todas (Figura 2) las especies de Bifidobacterium de tipo infantil (B. longum subsp, B. infantis, B. breve, B. bifidum,
y B. scardovii) en comparación con lactantes de control alimentados con fórmula
y más cerca de amamantar.
Ruminococcus gnavus, una especie mucolítica asociada con condiciones inflamatorias, fue significativamente mayor en niños de control alimentados con fórmula a los 3 y 6 meses en comparación con la fórmula control y los lactantes amamantados. B. infantis y
B. lactis fueron significativamente mayores en los animales alimentados con fórmula de prueba.
El seguimiento de B. infantis reveló una alta prevalencia de la proporción de la cepa LMG11588 en el grupo de fórmula control y no sustitución de cepas autóctonas. Análisis de patógenos a través de factores de virulencia reveló principalmente la presencia de
Clostridiodes difficile toxigénicos con una alta prevalencia y abundancia a los 3 y 6 meses de edad en el grupo de fórmula de control y una prevalencia significativamente menor en los alimentados con fórmula de prueba y lactantes amamantados.
Conclusiones:
Una fórmula infantil con una mezcla simbiótica específica de 6 HMOs y B. infantis más B. lactis apoyaron la expansión de HMOs beneficiosos que metabolizan las bifidobacterias a los 6 meses, especialmente especies de tipo infantil en todos los bebés.
La presencia inferior de R. gnavus mucolítico y C. difficile toxigénico en bebés alimentados con fórmula indica una mejor ecología intestinal a través de
reducción de factores de riesgo.
If you liked this post you may also like



Prácticas de alimentación inadecuadas en la infancia e impacto a largo plazo
